药审中心发布部分新注册分类化学仿制药可参照《人体生物等效性豁免指导原则》进行研发与技术审评的通知
来源:CDE 亦度正康 7月22日


摘要
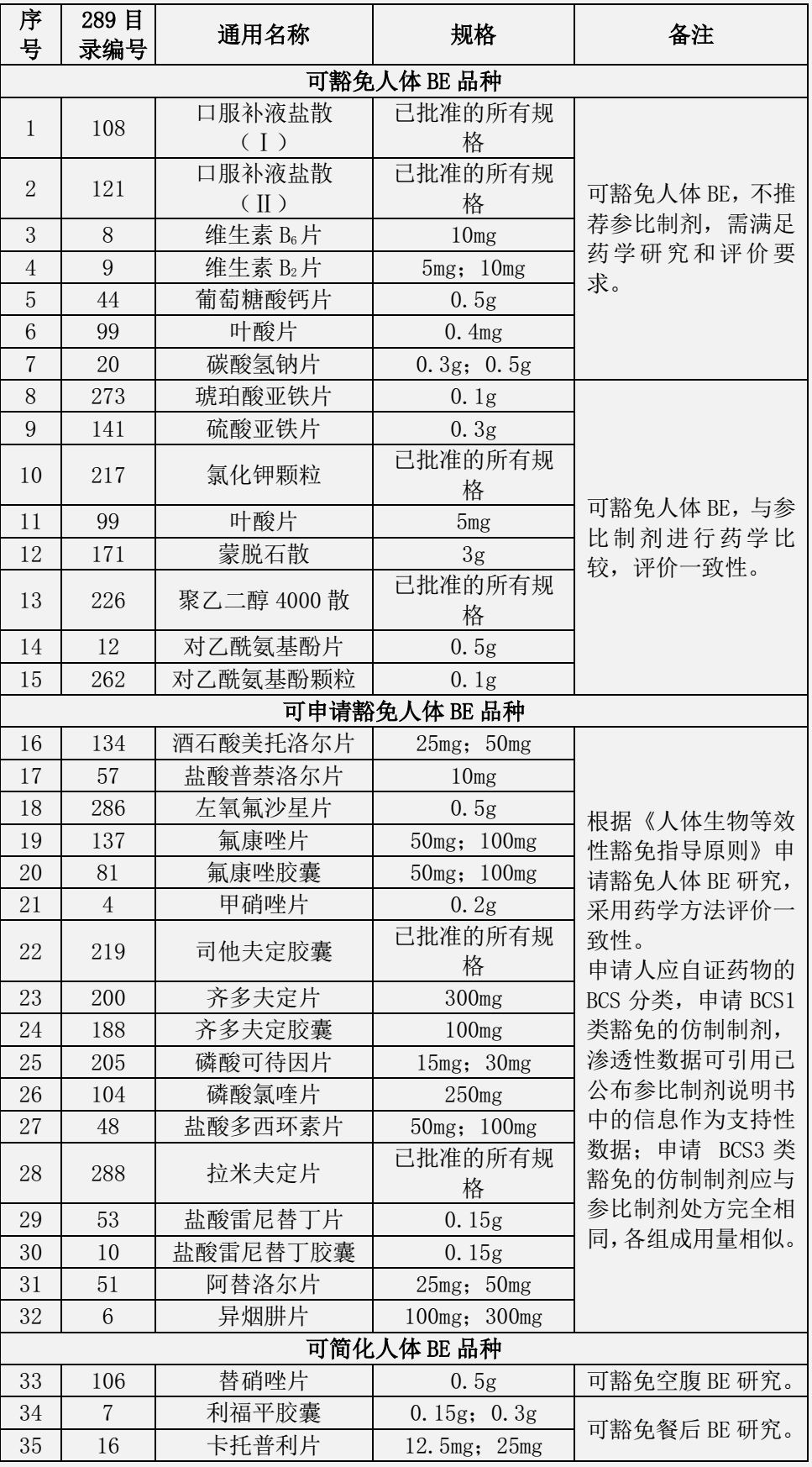
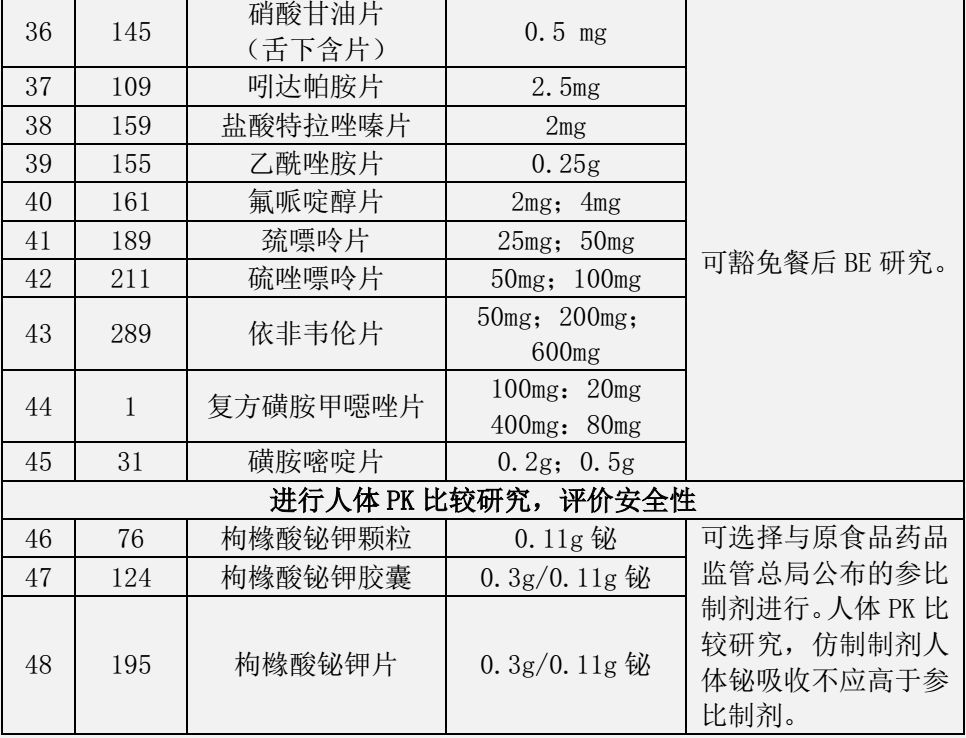
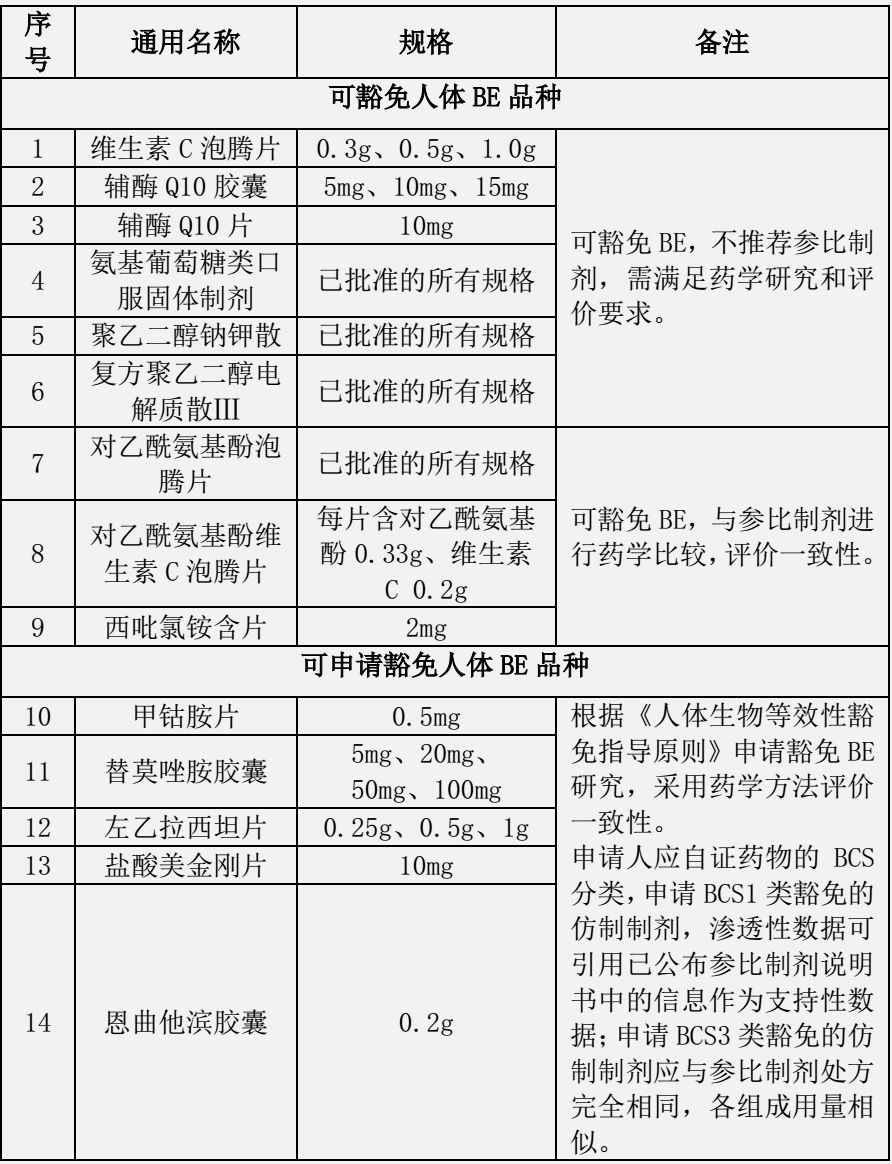
为统一口服固体仿制药一致性评价和新注册分类仿制药的技术审评尺度,药品审评中心发布通知,要求对于仿制国家药监局发布的《关于发布可豁免或简化人体生物等效性(BE)试验品种的通告》(2018年第32号)和《关于发布可豁免或简化人体生物等效性(BE)试验品种(第二批)的通告》(2018年第136号)所包含的品种,必需参照《人体生物等效性豁免指导原则》(2016年第87号)开展相关研究,经评估符合要求的,在申报化学仿制药注册时,可以同时申请豁免BE。
表1 可豁免或简化人体生物等效性(BE)试验品种
(2018年第32号)


表2 可豁免或简化人体生物等效性(BE)试验品种(第二批)
(2018年第136号)



